Десмин је протеин који се налази као средњи филамент у ћелијском скелету као и у пругастим и глатким мишићима. Његов задатак је стабилизирање ћелија и повезивање мишићних структура. Генетске промене (мутације) које изазивају поремећаје у синтези десмина повезане су са различитим мишићним болестима као што су десминопатија или кардиомиопатија.
Шта је десмин?
Десмин је грађевни блок ћелијског скелета (цитоскелета) направљен од протеина. Протеин такође стабилизује фине влакна мишића и јавља се у пругастим и глатким мишићима. Десмин филаменти припадају интермедијарним нитима (Филамента интермедиалиа), које биологија дели на пет различитих врста.
Према овој класификацији, десмин припада типу ИИИ заједно са протеином виментина, периферина и глиалних филамента (ГФАП). Налази из експеримената на животињама сугерирају да виментин може надомјестити недостајући десмин у раним фазама развоја или је у стању дјеломично преузети своје функције. Гени који кодирају десмин налазе се у људском геному на другом хромосому, у одељцима 219,99 до 220 Мб, а биологија која се користи да би се десмин назвала, због његове стабилизационе функције у ћелијском костуру. Скелетин. Научници Лазаридес и Хуббард први су то описали 1976. године.
Анатомија и структура
Као и сви протеини, десмин се састоји од дугих ланаца аминокиселина. Сви ови биолошки грађевни блокови слиједе исту основну структуру и само се међусобно разликују по свом специфичном остатку.
Синтеза протеина повезује поједине аминокиселине са пептидним везама; Секвенција појединих градивних блокова зависи од секвенце коју гени одређују кроз своју базну секвенцу. Десмин се састоји од укупно 470 аминокиселина. Готов пептидни ланац представља примарну структуру десмина, која тек у свом просторном облику постаје готов протеин. Након што се створи пептидни ланац, настају даљње везе спонтано или уз помоћ ензима, који су такође познати као водоничне везе и који или размештају ланац у хелик (алфа структура) или га обликују у лист (бета структура).
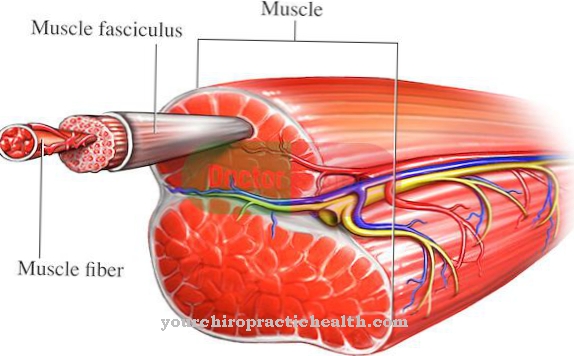
Десмин се састоји од дужих испружених резова и спиралних формација. Поред ове секундарне структуре, протеин претпоставља и сложенију терцијарну структуру, што је такође важно за каснију функцију протеина.Поред тога, у неким случајевима се разни савијени ланци аминокиселина комбинују да би добили квадратну структуру, унутар које се, у принципу, могу појавити и друге биомолекуле. Десмин је у секундарној, терцијарној и кватернарној структури као хомополимер: Полимер је структура која се састоји од неколико макромолекула. У случају хомополимера као што је десмин, ове макромолекуле или мономери су сви делови истог типа. Појединачни комплетирани десмински филамент има пречник од 8-11 нм.
Функција и задаци
Главни задатак Десмина је да ојача ћелијски костур и мишиће, при чему се јавља подједнако у глатким и пругастим мишићима. У биологији ћелијски скелет је структура унутар ћелија која се састоји од протеина и даје им облик и стабилност. Ћелијски костур такође учествује у транспорту супстанци унутар ћелије и у њиховом кретању.
За разлику од коштаног коштаног скелета људског тела, ћелијски скелет не формира фиксну јединицу, већ се флексибилно може прилагодити потребама ћелије. Испреплетени мишићи такође требају дезмин као везни део између З-дискова и миофибрила. З-дискови обележавају границе између суседних секција мишића (сарцомерес) у пругастим мишићима. На З-дисковима су причвршћене нитасте структуре које се састоје од комплекса актина и тропомиозина. Када се уговоре, ова миозинска влакна и влакна гурају се једно у друго, што узрокује да се ткиво у целини привремено скраћује.
Глатки мишићи имају другачију структуру од пругастих: влакна не формирају јасно ограничене нити и снопове са јасно видљивим пругама у пресеку, већ изгледају глатко и неструктурирано на први поглед. Међутим, контракција је у великој мери слична. Заједно са апаратима за немичне мишиће актина глатких мишића, Десмин такође има стабилизујућу функцију у мишићном ткиву стварајући чврсте везе у такозваним зонама компресије.
Болести
Разне мишићне болести повезане су са генетским променама (мутацијама) које утичу на уништавање. Код људи се они налазе на другом хромозому.
Чак и ако је таква болест урођена, не мора се одмах очитовати видљивим симптомима. У многим случајевима мутације десмина доводе до мишићне дистрофије, за коју је карактеристично прогресивно пропадање мишићног ткива. Изглед дистрофија је врло хетероген. Десминопатија је специфичнија клиничка слика. Ово је ретка наследна болест која постепено слаби мишиће и обично доводи до симптома само у одраслој доби. Грешке у сопственој производњи десмина у организму смањују и цитоскелет мишићних ћелија и З-дискове у десминопатији.
Поред тога, мутације десмина повезане су са кардиомиопатијом, која се такође може појавити у контексту десминопатије. Кардиомиопатија се манифестује функционалним срчаним проблемима и није увек последица поремећаја у синтези десмина; уместо тога, постоје разни могући узроци. Типични симптоми укључују срчану инсуфицијенцију, срчане аритмије, колапс циркулације (синкопа), ангину пекторис и емболизме.
Откривање антитела десмина такође помаже лекарима да разликују различите туморе - на пример рабдомиосаркоме (малигни тумори у меком ткиву са високом стопом смртности) и леиомиосаркоми (малигни тумори у глатким мишићима).




.jpg)


.jpg)







.jpg)