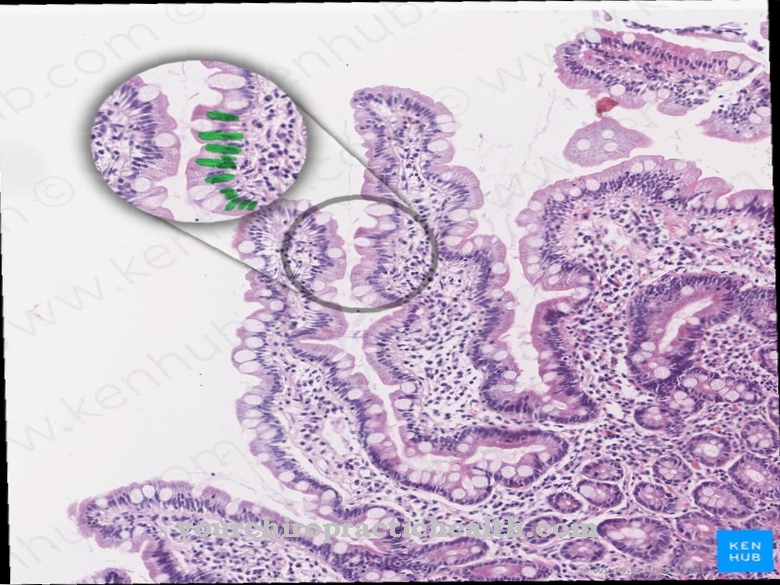
Еластин је структурни протеин који учествује у изградњи везивног ткива плућа, крвних судова и коже. За разлику од колагена, који се такође налази у везивном ткиву, он је врло еластичан. Молекули еластина међусобно се умрежавају у ванћелијском подручју.
Шта је еластин?
Сви кичмењаци садрже влакнасти протеин еластин. То је структурални протеин који је одговоран за обликовање тако важних органа као што су плућа, крвни судови или кожа. Заједно с колагеном формира везивно ткиво ових органа.
Својства еластина и колагена се надопуњују. Еластин је, као што му име каже, веома еластичан за разлику од колагена. То чини везивно ткиво коже, плућа и крвних судова еластичним и пропадљивим. Функције ова три органа захтевају стално промену величине. Еластин се углавном састоји од аминокиселина аланин, глицин, пролин, валин, лизин, леуцин и изолеуцин. Хидрофобна и хидрофилна подручја измјењују се унутар молекула.
Карактеристичне јединице четири аминокиселине аланин, пролин, глицин и валин понављају се у сваком хидрофобном домену. Хидрофилна подручја углавном садрже лизин. Остатак лизина се оксидује до ализина ензимом лизил оксидаза. Терминална амино група је замењена карбоксилном групом. Остаци лизина различитих протеинских ланаца комбинују се један са другим како би формирали десмозин у облику прстена и на тај начин различите ланце међусобно умрежили.
Функција, ефекат и задаци
Као структурни протеин унутар везивног ткива, еластин има задатак да обезбеди облик и еластичност плућа, крвних судова и коже. Сва три органа зависе од флексибилности везивног ткива. Подложни су сталним променама у количини.
Као структурни протеин, везивно ткиво има углавном колаген. Отпоран је на сузу, али би био превише чврст као једини структурни елемент. Само комбинација својстава еластина и колагена омогућава да везивно ткиво постане еластично и истовремено отпорно на кидање. Основни саставни део еластина је тропоеластин. Тропоеластин се састоји од наизменичних хидрофобних и хидрофилних домена. Има приближну молекулску масу од 72 килодалтона. Тропоеластинске јединице се међусобно умрежавају на остатке лизина.
Иако је тропоеластин растворљив у води због многих хидрофилних домена, растворљивост у води умреженог полимера се негира. Тропоеластин се формира унутар ћелија и доспева у ванћелијски део мембранским транспортом. Овде се одвија умрежавање основних грађевних блокова, при чему се на тачкама умрежавања формирају прстенасте десмозинске јединице. Три остатка ализина и један остатак лизина увек учествују у стварању десмозина. Пошто је ализин продукт оксидације лизина, четири остатка лизина су на крају повезани један са другим.
Овакав облик повезивања даје еластину посебну еластичност. Умрежавање такође штити еластин од денатурације и деградације готово свих протеаза. Међутим, изузетак је ензим еластаза и то је једина протеаза која може разградити еластин. На овај начин се разграђују еластини који се узимају кроз храну.
Образовање, појава, својства и оптималне вредности
Као што је већ споменуто, еластин је неопходна компонента везивног ткива плућа, крвних судова и коже. Ово утиче на све кичмењаке. Основни грађевни блок тропоеластин тешко се може открити у животињском ткиву. Након претварања остатака лизина у алинин лизил-оксидазом, три ализинска остатка се одмах умрежавају са једним лизинским остатком. Еластин се јавља готово искључиво у умреженом облику.
Ипак, откривање тропоеластина у експериментима на животињама инхибирањем синтезе лизиксоксидазе било је успешно. Ако овај ензим недостаје, не долази до конверзије лизина у ализин, а самим тим ни до стварања еластина. Због отпорности еластина на пропад протеаза, кожа, плућа и крвни судови су идеално заштићени. Деградативни ефекат еластазе је ограничен инхибиторима еластазе.
Болести и поремећаји
Мутације гена ЕЛН могу проузроковати насљедне болести код којих се мијења структура еластина. Код такозване дерматокалазе долази до промена везивног ткива, које се манифестују у нееластичној, опуштеној кожи која се савија у наборима.
Болест може бити и стечена и наследна. Примећују се породични кластери. Поред многих других симптома, ова слабост везивног ткива се јавља и код Виллиамс-Беурен синдрома. Ово је такође наследна структурна аномалија еластина. Узрок ове болести је мутација на хромозому 7. Надаље, постоји и прирођена аортна стеноза, која се заснива на поремећају у структури еластина. Главна артерија срца је сужена. Доток крви из леве коморе у крвоток је одгођен.
Затајење срца се јавља дугорочно. Пет до шест процената свих урођених срчаних мана су урођене аортне стенозе. За неке облике Ехлерс-Данлос синдрома се такође сматра да су еластин малформације. Ову болест карактерише презатезна кожа која се назива гуменом кожом. Слабост везивног ткива утиче на многе органе, укључујући срце и пробавни тракт. Синдром се обично наслеђује као аутосомно доминантно својство.
У такозваном Менкес синдрому, поред многих других симптома, постоји и слабост везивног ткива, чији се узрок налази у поремећеној синтези еластина. Заправо, Менкесов синдром карактерише поремећај у апсорпцији бакра у организму. Међутим, бакар је кофактор многих ензима. Између осталог, ово укључује и лизил оксидазу. Без бакра, ензим је неефикасан. Конверзија остатака лизина у алилизин више се не врши. Као резултат тога, умрежавање остатака лизина у десмосин више не може функционисати.




.jpg)

.jpg)





.jpg)