флуор представља хемијски елемент са атомским бројем 9 и спада у халогене. То је снажно корозиван гас који озбиљно оштећује слузницу. Флуор се употребљава медицински у облику соли, флуорида, за јачање зуба.
Шта је флуор?
Флуор је високо каустичан и реактиван гас и није једињење, већ хемијски елемент који припада халогенима. Са атомским бројем 9 то је најлакши халоген. У природи се флуор јавља углавном у облику његових соли, флуорида.
Гас флуор није веома стабилан и реагује са готово свим једињењима и елементима одмах након његове производње. Само са племенитим гасовима хелијум и неон нема реакције. Ова изузетно јака реактивност може се објаснити њеним врло јаким афинитетом за електроне. Увек повлачи електроне од својих реакционих партнера и стога је најјаче оксидационо средство. Назив флуор потиче од латинског "флуорес" (река). Као флуорид калцијума (флуорспар) служи као флукс за руде.
Када се руди додаје флуорпар, он смањује њихову тачку топљења тако да оне брже постају течне. Са концептуалног становишта, у медицини постоји термин флуор гениталис за крваво излучивање секрета из женских гениталија. Међутим, генитални флуор се не сме бркати са елементом флуора.
Функција, ефекат и задаци
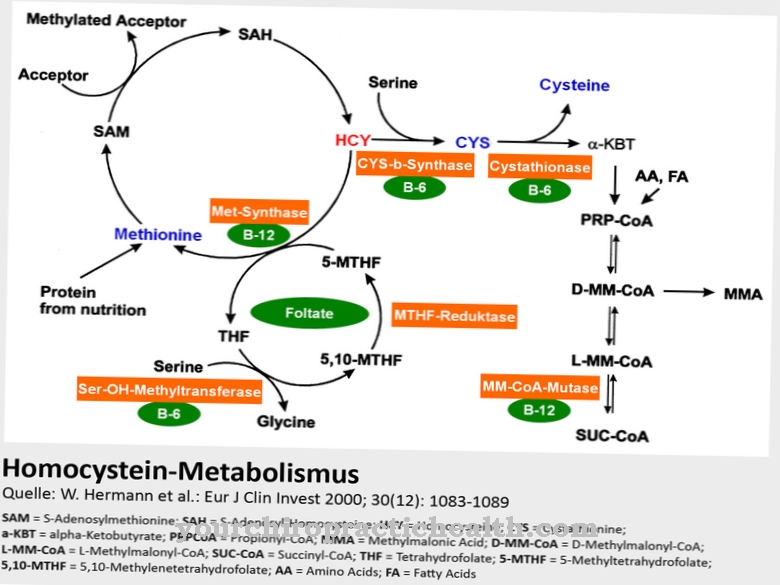
Флуор се назива битним елементом у траговима. Међутим, значај флуора је контроверзан. Познато је да флуориди имају заштитна својства против зуба. Флуор може ојачати зубе и истовремено инхибира одређене ензиме каријесних бактерија који изазивају разградњу угљених хидрата.
Флуориди делују директно на зуб. Перорални унос флуорида нема утицаја на зубе. Зуби се састоје углавном од минералног хидроксиапатита. Хидроксиапатит може бити нападнут киселинама које настају разградњом остатака хране. Због лоше хигијене зуба често настају рупе у зубима које су још увек заузеле каријесне бактерије. На пример, ако паста за зубе садржи флуорид, долази до размене хидроксилних јона за флуоридне јоне. Ово ствара флуорапатит, који се испоставља тврђим материјалом и мање је осетљив на киселине. Чак и хидроксиапатит растворен у киселинама може се поново исталожити као флуороапатит у присуству флуорида.
Тако се почетно уништење може преокренути. Али флуориди такође имају позитивна својства за изградњу костију. Овде се унос врши орално. Деци и бебама се дају флуор и витамин Д да спрече рахитис. Међутим, флуорид се не треба предозирати, тако да се флуороза са учвршћивањем и задебљањем зглобова не може развити. Једињења флуора такође су одобрена као лекови за остеопорозу. Одговарајуће таблете садрже натријум-флуорид или динатријум-флуорофосфат.
Образовање, појава, својства и оптималне вредности
Флуор се садржи у облику флуорида у црном и зеленом чају, шпарогама, а такође и у риби. Многе соли садрже флуор. Не постоје чисте соли флуора због мале растворљивости једињења која садрже флуор у води. Флуорспар (калцијум-флуорид) и флуорапатит су најчешћи у земљиној кори.
Флуор се углавном прави од калцијумовог флуорида. Постоје чак и организми који могу да чине органофлуоринска једињења. Јужноафрички гифблаар или биљке рода Дицхапеталум могу синтетизовати флуорооцтену киселину против грабежљиваца. Људски организам има дневну потребу од 0,25-0,35 мг.
Болести и поремећаји
Међутим, тровања повезана са флуором и здравствени проблеми су чешћи. Као што је раније поменуто, чисти флуор је врло отровни корозивни гас. Ово такође отежава стварање флуора.
Пошто реагује са готово свим материјалима, такође се може складиштити и превозити веома слабо. Отровни флуором, хемијска опекотина и опекотине настају у плућима, на кожи и у очима. У зависности од дозе, релевантни органи се растварају у кратком времену, што резултира смрћу. Смртоносна доза је врло мала и износи 185 ппм. Тровање флуором чистим флуором ретко ће се догодити јер гас није стабилан. Међутим, тровање хидроген-флуоридом је слично опасно. Водоник флуорид формира водоничне везе са протеинима у телу, при чему се уништава терцијарна структура протеина. Одвија се денатурација телесних протеина.
Флуориди могу да формирају сложена једињења са јонима алуминијума који имају сличан ефекат као фосфати. У телу, ова једињења интервенишу у реакцијама фосфорилације. Између осталог, ово доводи до дерегулације Г протеина, при чему се многи ензими инхибирају. Само из овог разлога, тело не подноси повећану дозу флуорида. Узимање превише таблета флуора такође може довести до мучнине, повраћања и дијареје. Флуорид реагује са желучаном киселином, при чему настаје мала количина флуороводичне киселине. Ово напада слузницу. Хронично, благо предозирање флуорида може довести до флуорозе.
Флуороза је хронично тровање флуором са променама структуре зубне цаклине, кашљем, испљуваком и недостатком даха. Превише хидроксиапатита претвара се у флуороапатит у зубима. Зуби постају ломљивији. Кости се такође мењају због прекомерног стварања флуорапатита. Кости се полако укрућују и преуређују. Поред тога, ензим енолаза је инхибиран.

.jpg)









.jpg)




.jpg)

.jpg)