Тхе Индукција-фит-Теорија се враћа на Косхланд и одговара проширењу принципа закључавања кључа који се заснива на тачности уклапања анатомских структура. Индуцирани фит се односи на ензиме попут киназе који мењају своју конформацију да би формирали ензим-лиганд комплекс. У случају оштећења ензима, поремећај може утицати на индуковани принцип фит.
Шта је индуковано фит?

Многи процеси у телу раде по принципу закључавања кључа или рукавице. Ово се односи, на пример, на зглобне везе. Зглобна глава захваћа се у зглобу попут кључа у брави или рука у рукавици. Врата се отварају само када је кључ тачно у брави. У истом контексту одређене функције тела се отварају тек када се структуре прецизно сусретну.
Индуцед-фит је посебан облик принципа кеи-ин-лоцк. Ово је теорија за формирање протеинско-лигандских комплекса, на пример ензимско-супстратног комплекса у контексту реакција катализираних ензимима.
Сматра се да је Даниел Е. Косхланд први који је описао теорију и да је први постулирао 1958. године. За разлику од принципа закључавања кључева, теорија индукованог прилагођавања не претпоставља две статичке структуре. Посебно у случају протеинско-лигандских комплекса, конформациона промена укљученог протеина требало би да омогући да се комплекс формира. Лиганд и протеин, или боље речено ензим, Косхланд је посматрао као динамичан и говорио је о интеракцији која оба партнера покреће на промену конформације ради стварања комплекса.
Функција и задатак
Постоји специфичност везивања између ензима и супстрата. Ова специфичност везивања подразумева принцип закључавања кључева. Сваки ензим има активни центар. За сложене формације с лигандом, овај центар је прецизно обликован на начин да се скоро савршено подудара с просторним обликом планиране подлоге.
Међутим, код многих ензима, активни центар је у сваком случају у облику који није баш прецизан све док није везан за супстрат. Чини се да ово опажање протурјечи принципу закључавања, јер ензими и њихови лиганди у почетку изгледају као да прилагођавају њихов облик.
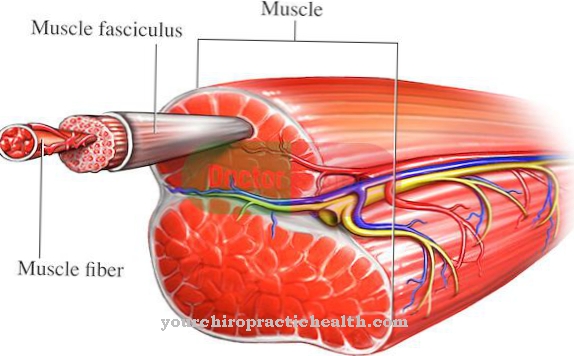
Чим се ензим веже за лиганд, стварају се интермолекуларне интеракције. Ове интеракције на међумолекуларном нивоу доводе до промене конформације ензима. Конформација се односи на различите могуће распореде појединих атома у молекулу који настају као последица једноставне ротације око неке осе. Промјена конформације ензима одговара промени просторног распореда њихових молекула и само омогућава формирање ензимско-супстратног комплекса.
Хекокиназа као ензими катализује, на пример, први корак гликолизе. Чим ти ензими дођу у контакт са супстром глукозом, може се приметити индуковано стапање у смислу стварања "индукованог фитања". Ензим хексокиназа фосфорилира своју лиганду глукозу трошећи АТП да би формирао глукоза-6-фосфат.
Структура воде наликује оној у алкохолној групи Ц6 атома, коју ензим фосфорује током реакције. Због мале величине, молекули воде би се могли везати за активни центар ензима, тако да би настала хидролиза АТП-а. Међутим, индуковани фит омогућава хекокинази да катализује конверзију глукозе са високом специфичношћу, тако да се у малој мери мора догодити хидролиза АТП-а. Са механизмом индукованог постављања, специфичност подлоге се повећава.
Принцип унутар људског организма може се поштовати нарочито у случају киназа. Индукована адаптација се не односи на сваки комплекс лиганда-рецептора, јер је конформациона промена оба партнера у многим случајевима природна граница.
Болести и тегобе
Принцип индукованог фитања је поремећен у случају различитих оштећења ензима. На пример, у фенилкетонурији ензими су ограничени у својој активности или потпуно пропадају. Обично је то последица генетске оштећења. Код фенилкетонурије, ензим фенилаланин хидроксилаза је оштећен. Фенилаланин се више не претвара у тирозин и на тај се начин накупља. Настају неуротоксичне супстанце, тако да поред менталних оштећења, пацијент има тенденцију грчења. Оштећења ензима обично су генетска и узрокују је погрешно кодирана секвенца аминокиселина у ДНК.
Метаболичке болести изазване дефектима ензима и таквим поремећеним принципом индукованог фитања познати су под називом ензимопатије. Дефекти пируват киназе присутни су, на пример, у неправилно кодирајућем ПКЛР гену. Овај ген је смештен на локусу гена 1к22 хромозома 1. Познате су различите мутације ПКЛР алела пируват киназе, које се појављују као оштећења у Р облику.
Херсова болест поново се назива гликогеноза типа ВИ и припада групи болести складиштења гликогена. То је аутосомно рецесивни или Кс-везани поремећај метаболизма услед оштећења ензима. Тачније, узрок лежи у различитим дефектима ензима у систему фосфорилаза киназе унутар јетре и мишића. У овом контексту су познати, на пример, Кс-везани дефект фосфорилаза-б-киназе у јетри, дефект фосфорилазе јетре аутосомно рецесивног наследства и комбиновани неуспех фосфорилаза-б-киназе у јетри и мишићима.
У вези са фосфорилазом јетре, узрочне мутације су локализоване на гену ПИГЛ и због тога су на хромозому 14к21 до к22. Комбиновани недостатак фосфорилазе мишића јетре повезан је са мутацијама у ПХКБ гену у локусу 16к12-к13. Идентификоване су узрочне мутације у гену ПХКА2 на локусу Ксп22.2-п22.1 за дефект Кс-јетре у фосфорилаза кинази јетре. Друге гликогенозе такође могу да откажу индуковани ефекат фит одговарајуће киназе или да је отежају.




.jpg)


.jpg)







.jpg)