Миосин спада у моторне протеине и између осталог је одговоран за процесе који укључују мишиће у контракцији. Постоје различите врсте миозина који сви учествују у транспортним процесима ћелијских органела или у променама унутар цитоскелета. Структурна одступања у молекуларној структури миозина могу под одређеним околностима бити узрок мишићних болести.
Шта је миозин?
Уз динин и кинезин, миозин је један од моторних протеина који су одговорни за процесе кретања ћелије и транспортне процесе у ћелији. За разлику од остала два моторна протеина, миозин делује само са актином. Актин је, пак, део цитоскелета еукариотске ћелије. Стога је одговоран за структуру и стабилност ћелије.
Даље, актин с миозином и два друга структурна протеина формирају стварну контрактилну структурну јединицу мишића. Две трећине контрактилних протеина у мишићима су миозини, а једна трећина актин. Међутим, миозини нису присутни само у мишићним ћелијама, већ и у свим осталим еукариотским ћелијама. Ово се односи на једноћелијске еукариоте као и на биљне и животињске ћелије. Микрофиламенти (актински филаменти) су укључени у структуру цитоскелета у свим ћелијама и заједно са миозином контролишу протоплазматске струје.
Анатомија и структура
Миозини се могу поделити у различите класе и подкласе. Тренутно је познато преко 18 различитих класа, од којих су најважније класе И, ИИ и В. Миозин који се налази у мишићном влакну назива се конвенционалним миозином и припада класи ИИ. Структура свих миозина је слична. Све се састоје од дела главе (миозинова глава), дела врата и дела репа.
Миозински филаменти скелетног мишића састоје се од око 200 молекула миозина ИИ, сваки са молекулском тежином од 500 кДа. Глава је генетски врло конзервативна. Подјела на структурне класе углавном је одређена генетском варијабилношћу репног дијела. Део главе се веже за молекул актина, док део врата делује као шарка. Ревни делови неколико молекула миозина акумулирају се и формирају филаменте (снопове). Молекул миозина ИИ састоји се од два тешка и четири лагана ланца.
Два тешка ланца творе такозвани димер. Дужи од два ланца има алфа-спиралну структуру и састоји се од 1300 аминокиселина. Краћи ланац се састоји од 800 аминокиселина и представља такозвани моторни домен, који чини део дела молекула, који је одговоран за кретање и транспортне процесе. Четири лагана ланца повезана су са главом и вратом тешких ланаца. Лагани ланци који се налазе даље од главе називају се регулаторни, а лаки ланци близу главе као битни ланци. Они су веома афинисани калцијумом и на тај начин могу да контролишу покретљивост дела врата.
Функција и задаци
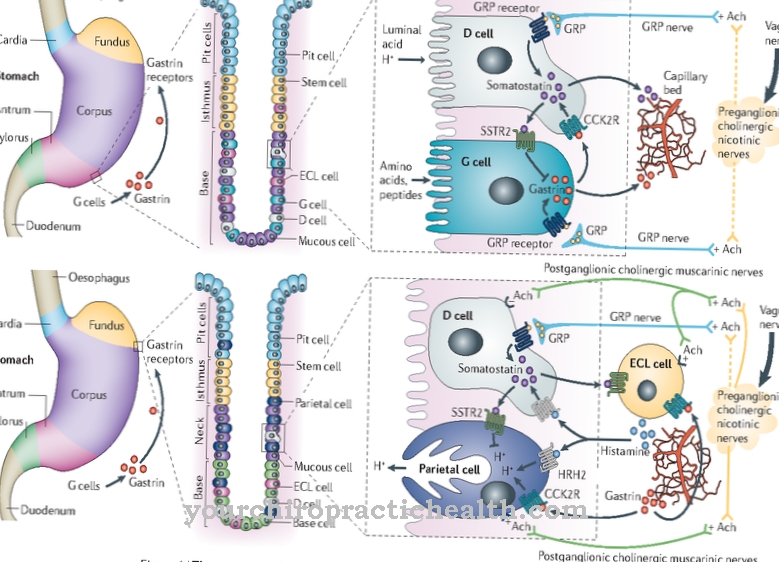
Најважнија функција свих миозина јесте транспорт ћелијских органела у еукариотским ћелијама и обављање промена унутар цитоскелета. Конвенционални молекули миозина ИИ, заједно са актином и протеинима тропомиозином и тропонином, одговорни су за контракцију мишића. Да би се то постигло, миозин се најпре интегрише у З-дискове сацомер-а користећи протеин титин. Шест титинских филамената фиксира миозинску нит.
У сацомеру, миозинска нитна формира око 100 унакрсних веза са страна. У зависности од структуре молекула миозина и садржаја миоглобина, може се разликовати више облика мишићних влакана. Контракција мишића одвија се унутар сацомер-а због кретања миозина у циклусу унакрсног моста. Пре свега, глава миозина је чврсто везана за молекул актина. Затим се АТП подели на АДП, при чему ослобођена енергија доводи до затезања главе миозина. Истовремено, лаки ланци осигуравају повећање јона калцијума. Због тога се глава миозина везује за суседни молекул актина као резултат промене конформације.
Ослобађањем старе везе, напетост се сада претвара у механичку енергију такозваним ударним силама. Покрет је сличан ударцу весла. Глава миозина се нагиње од 90 степени до између 40 и 50 степени. Резултат је покрет мишића. Током контракције мишића, скраћује се само дужина сацомер-а, док дужине актинских и миозинских филамента остају исте. Доступност АТП у мишићима довољна је само око три секунде. Разградњом глукозе и масти АДП се претвара у АТП тако да се хемијска енергија још увек може претворити у механичку енергију.
Болести
Структурне промене миозина изазване мутацијама могу довести до болести мишића. Пример такве болести је породична хипертрофична кардиомиопатија. Породична хипертрофична кардиомиопатија је наследна болест која се наследјује као аутосомно доминантно својство. За болест је карактеристично задебљање леве коморе без дилатације.
Са преваленцијом од 0,2 процента у општој популацији, релативно је честа болест срца. Ову болест изазивају мутације које доводе до структуралних промена бетамиосина и алфхатропомиосин. Ово није једна него неколико тачака мутације протеина који су укључени у структуру сацомер-а. Већина мутација је смештена на хромозому 14. Патолошки се болест манифестује задебљањем мишића у левој комори.
Ова асиметрија дебљине срчаног мишића може довести до кардиоваскуларних тегоба са срчаним аритмијама, недостатка даха, вртоглавице, губитка свести и ангине пекторис. Иако многи пацијенти имају слабо или нимало оштећење рада срца, може се развити прогресивна срчана инсуфицијенција.











.jpg)
.jpg)

.jpg)
.jpg)